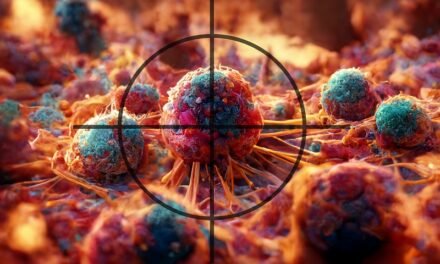
Geny decydują o większości naszych cech, zwłaszcza fizycznych, o wzroście, kolorze włosów czy oczu. Niestety, czasem warunkują one w naszym organizmie również rozwój choroby nowotworowej. Nowotwór należy postrzegać nie jako chorobę narządu, ale pojedynczych komórek, w genomach których doszło do patogennych zmian i w konsekwencji do niekontrolowanych podziałów komórek (rysunek 1).
Ponieważ mutacje mogą zajść niemalże w dowolnej komórce naszego organizmu, niezależnie od narządu, specjalistyczne testy genetyczne odgrywają ogromne znaczenie w diagnostyce i leczeniu nowotworów [1]. Nowością na polu diagnostyki genetycznej nowotworów jest tzw. analiza całego genomu. To najnowocześniejsza technologia, z którą naukowcy wiążą wielkie nadzieje.
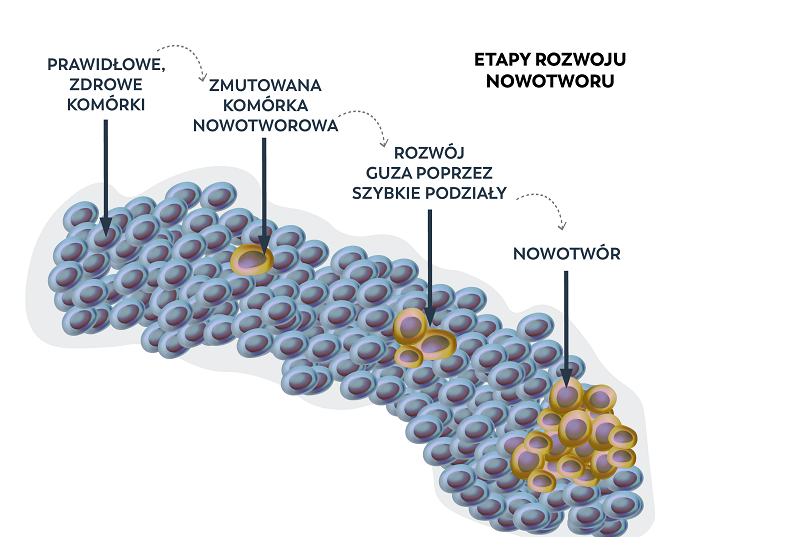
Rysunek 1. Chorobotwórcze zmiany genetyczne w jednej komórce mogą prowadzić do rozwoju guza nowotworowego, niezależnie od tkanki czy organu.
Powszechnie stosowane genetyczne testy diagnostyczne można porównać do tytułu wielotomowej powieści: choć nawiązuje on do treści książki, to nie reprezentuje w pełni ukrytej w tekście historii. Analogicznie, identyfikacja mutacji w kilku genach może potwierdzić obecność nowotworu, jednak często nie daje pełnej informacji o jego przyczynach i molekularnym mechanizmie rozwoju. W konsekwencji, utrudnia to dobór skutecznej terapii.
Onkolodzy coraz częściej sięgają po innowacyjne metody diagnostyki genomowej, które pozwalają na identyfikację wszystkich mutacji prowadzących do rozwoju choroby nowotworowej. Jedną z nich jest analiza całego genomu, która ma szansę zrewolucjonizować leczenie onkologicznego i wydłużyć życie pacjentów z zaawansowanym nowotworem [2].
Przed decyzją o wykonaniu badań genetycznych warto zapoznać się z zaletami oraz ograniczeniami dostępnych na rynku metod diagnostycznych [1].
Diagnostyka genetyczna nowotworów
Powszechnie stosowane genetyczne testy diagnostyczne mają sporo ograniczeń. Przez wiele lat analizowano jedynie mutacje w sekwencji genów, mimo, że większość materiału genetycznego stanowią tzw. regiony międzygenowe. Wiele badań dowodzi, że mają one istotny wpływ na regulację procesów molekularnych w komórkach.
Najprostsze testy genetyczne wykorzystują klasyczne sekwencjonowanie metodą Sangera, która umożliwia odczyt pojedynczych patogennych wariantów genetycznych (potocznie: mutacji chorobotwórczych) w konkretnych genach [1,3]. Ta metoda jest dobrym rozwiązaniem w przypadku pacjentów z obciążeniem genetycznym, np. gdy pośród bliskich krewnych występowała choroba nowotworowa.
Możliwe jest również wykonanie sekwencjonowania celowanego (ang. Targeted Sequencing), które skupia się na wybranych fragmentach genów. Dzięki temu analizowane są te regiony materiału genetycznego, w których występuje najwyższe prawdopodobieństwo wykrycia mutacji.

Rysunek 2. 1. Zakres badania całogenomowego (WGS) – wszystkie chromosomy, cała informacja genetyczna zawarta w komórkach 2. Zakres badania panelowego – kilkanaście/kilkadziesiąt fragmentów genów.
Tradycyjne testy panelowe
Najbardziej popularne na rynku są aktualnie testy “panelowe” służące do analizy kilku lub kilkudziesięciu wybranych genów, w których najczęściej dochodzi do mutacji w określonym typie nowotworu [1,3]. Dobrym przykładem jest powszechnie wykorzystywany panel genowy do badania raka piersi, który obejmuje analizę sekwencji dwóch genów: BRCA1 i BRCA2.
Nazwa “panel genowy” może wprowadzać w błąd: często badanie obejmuje zaledwie jeden lub kilka fragmentów sekwencji, których mutacje wpływają na rozwój choroby, a więc analizowanych jest tylko kilka liter w sekwencji całego genu. Choć badania tego typu są atrakcyjne cenowo, pomijają one mutacje występujące w innych fragmentach genu oraz w sekwencjach DNA pomiędzy genami [3].
Analiza całego genomu w oparciu o sekwencjonowanie DNA
Najnowocześniejsza technologia diagnostyczna dostępna dla pacjentów onkologicznych to analiza całego genomu, czyli tzw. profilowanie całogenomowe. Sekwencjonowanie całego DNA (z wykorzystaniem WGS, ang. Whole Genome Sequencing), czyli kompletnej informacji genetycznej znajdującej się w komórkach nowotworu, umożliwia zbadanie aż 99,9% całego materiału genetycznego, a więc wszystkich genów oraz sekwencji międzygenowych [1,2,3].
Warto pamiętać, że geny stanowią jedynie niewielki procent naszego DNA (około 1-2%). Bardzo długie sekwencje, które występują pomiędzy nimi, mogą mieć także istotny wpływ na rozwój choroby nowotworowej (rysunek 2).
Analiza całego genomu (profilowanie genomowe) to jedyna metoda wykorzystująca sekwencjonowanie, która dodatkowo pozwala na wykrycie dużych zmian strukturalnych w chromosomach. Ponieważ cała sekwencja genomu to około 3 200 000 000 par nukleotydów, analiza i interpretacja uzyskanych informacji wymaga dużo czasu, zaawansowanych narzędzi informatycznych oraz udziału specjalistów z zakresu analityki genomowej [1].
Choć na pozór kosztowna, analiza całego genomu z wykorzystaniem sekwencjonowania staje się z roku na rok coraz bardziej przystępna cenowo. Warto podkreślić, że badanie całego genomu swoim zakresem obejmuje wszystkie pozostałe (tradycyjne) testy (tabela 1).
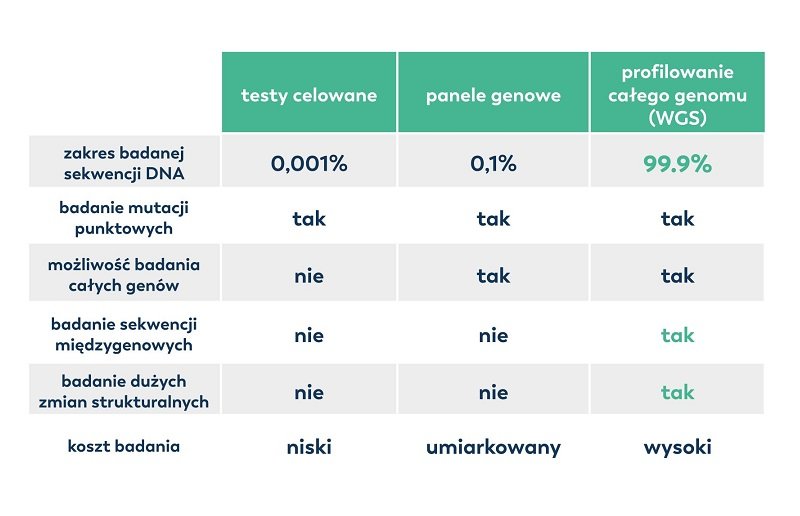
Tabela 1. Porównanie dostępnych metod diagnostyki genetycznej.
Analiza całego genomu – zastosowanie w onkologii
Nowotwór wywodzący się z tej samej tkanki nigdy nie jest tą samą chorobą – u różnych pacjentów może być wynikiem odmiennych mutacji DNA. I odwrotnie, nowotwory z dwóch różnych tkanek, u dwóch różnych pacjentów (na przykład nowotwór piersi u jednej pacjentki i nowotwór trzustki u innej) mogą być wywołane przez mutację w tym samym genie.
Profilowanie i analiza całego genomu umożliwiają wskazanie zmian genetycznych, które doprowadziły u danego pacjenta do onkogenezy oraz na dobranie indywidualnej terapii, która ma największe szanse powodzenia w danym przypadku [1].
Diagnostykę całogenomową i terapię celowaną zastosowano z powodzeniem u pacjentek z rakiem piersi. Poprzez identyfikację mutacji odkryto zmiany w funkcjonowaniu komórek, które stały się celem terapeutycznym. Dzięki temu, na rynek zostały wprowadzone leki i terapie celowane – ukierunkowane na receptor HER2 (ang. Human epidermal growth factor receptor 2).
Amerykańskie Towarzystwo Onkologiczne podaje, że terapię celowaną ukierunkowaną na receptor HER2 można zastosować u około 15% pacjentek z rakiem piersi. Terapeutyki celowane mogą również pomóc pacjentkom, u których potwierdzono status receptorów hormonalnych ER (estrogen) i PR (progesteron) jako pozytywny. Oznacza to, że na powierzchni komórek nowotworowych znajduje się duża liczba tych receptorów, a zatem pacjentki dobrze odpowiadają na leczenie hormonalne.
Niektóre terapie celowane jak np. inhibitory enzymów CDK4/6, mTOR czy PIK3 są w stanie zwiększyć skuteczność stosowanej terapii hormonalnej. Podobnych leków na rynku przybywa, a prace badawcze nad nowymi terapeutykami ukierunkowanymi na cele molekularne posuwają się do przodu [3,5,6].
Analiza całego genomu otwiera drzwi do skutecznej terapii również w raku jajnika. Jest to nowotwór niezwykle trudny do leczenia, ponieważ powstaje w wyniku różnorodnych zmian w DNA guza. Standardowe postępowanie obejmuje chirurgiczne usunięcie guza, a następnie chemioterapię opartą na związkach zawierających platynę. Choć początkowo taka terapia przynosi efekt, to w większości przypadków dochodzi do rozwoju oporności na terapię platyną, co prowadzi w konsekwencji do słabszej odpowiedzi na kolejne próby leczenia.
Alternatywnym rozwiązaniem jest zastosowanie terapii celowanej, indywidualnie dobranej dla danej pacjentki na podstawie konkretnych zmian w genomie komórek jej nowotworu.
Dobrym przykładem są stosowane w praktyce klinicznej inhibitory PARP. Do leczenia z ich użyciem kieruje się pacjentki na podstawie wyników sekwencjonowania genów BRCA1/BRCA2, jeśli w tych genach zostaną zidentyfikowane warianty patogenne [3,7]. Okazuje się, że niektóre pacjentki pomimo braku mutacji w genach BRCA1/BRCA2 również mogą odnieść korzyść terapeutyczną z zastosowania inhibitorów PARP.
Wyzwaniem dla naukowców pozostaje rozpoznanie nowych zjawisk molekularnych, które określą grupę chorych mogących być beneficjentem takiego leczenia.
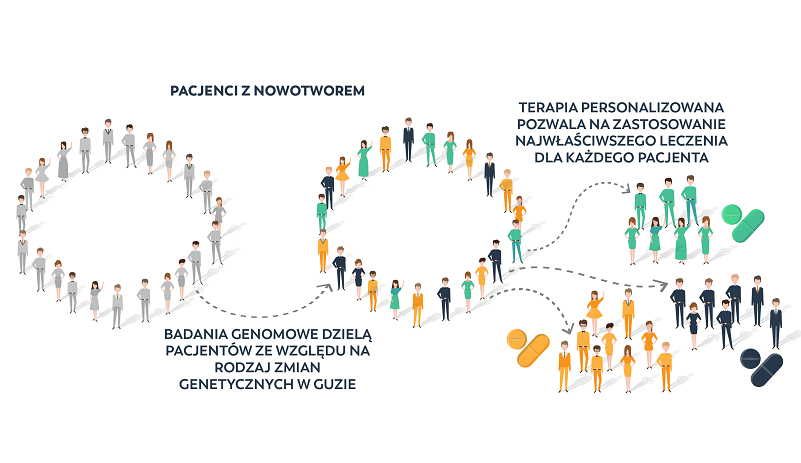
Rysunek 3. Przebieg terapii personalizowanej: na podstawie diagnostyki genetycznej grupę pacjentów z tym samym schorzeniem rozdziela się na różne typy molekularne choroby (kolory zielony, pomarańczowy i grafitowy). Dla każdej z tych grup dobierany jest lek o najlepszym możliwym działaniu terapeutycznym.
Analiza całego genomu – korzyści dla pacjentów
Poznanie zmian w genomie, które doprowadziły do rozwoju danego nowotworu, pozwala pacjentom i lekarzom bardziej świadomie walczyć z chorobą. Przede wszystkim umożliwia dobranie terapii, która ma największą szansę na powodzenie. W wielu przypadkach terapie celowane okazują się być mniej toksyczne i bardziej efektywne niż standardowe terapie przeciwnowotworowe (rysunek 3).
Na całym świecie trwają intensywne badania nad rozwojem nowych leków przeciwnowotworowych, prowadzone są setki badań klinicznych z ich wykorzystaniem. [1,8].
Dodatkowo, analiza całego genomu może wskazać, czy pacjent jest oporny lub wrażliwy na zastosowanie konkretnego leczenia oraz czy wariant genetyczny, który spowodował powstanie guza, może zostać odziedziczony przez kolejne pokolenia. Jest to istotne dla potomstwa pacjenta, a ponadto oszczędza – cenny dla pacjentów – czas.
Bankowanie tkanki nowotworowej
Profilowanie nowotworów i analiza całego genomu wymagają, aby pobrana tkanka guza była odpowiednio przechowywana i nie uległa degradacji lub zanieczyszczeniu. Do wykonania rutynowych badań histopatologicznych wykorzystuje się komórki pobrane od pacjenta w trakcie resekcji guza lub biopsji. Jednak rutynowo stosowany sposób ich przechowywania uniemożliwia przeprowadzenie diagnostyki genomowej i histopatologicznej za jednym razem.
Innowacyjnym rozwiązaniem jest bankowanie tkanki nowotworowej. Podczas rutynowej procedury lekarz rozdziela pobraną tkankę guza na dwie części. Pierwsza przeznaczona jest do standardowych badań histopatologicznych, a druga – do bankowania i ewentualnej diagnostyki genomowej. Bankowana tkanka guza zostaje umieszczona w specjalnym buforze konserwującym, a następnie poddana kontroli jakości i zamrożona w -20°C.
Tak zabezpieczona tkanka może być przechowywana przez kilka lat. W tym czasie pacjent ma możliwość wykorzystania jej do różnego rodzaju genetycznych badań diagnostycznych, w tym analizy całego genomu.
W Polsce pacjenci mogą bankować tkankę nowotworową w Polskim Centrum BioBankowania (PCBB). Jeśli pacjent wyrazi takie życzenie, pracownicy PCBB przesyłają odpowiednie materiały pobraniowe do prowadzącej leczenie jednostki medycznej, zajmują się transportem tkanki, kontrolą jakości i przechowują zabezpieczoną próbkę do 5 lat.
Pacjent otrzymuje niezbędne materiały informacyjne i kod zapewniający bezpieczeństwo danych osobowych. Jednym z pierwszych szpitali, który nawiązał współpracę z PCBB jest Centralny Szpital Kliniczny MSWiA w Warszawie, którego pacjenci już teraz mogą korzystać z usługi bankowania.
Bankowanie tkanki nowotworowej daje pacjentowi możliwość skorzystania z badania jakim jest analiza całego genomu. W konsekwencji możliwe staje się poszukiwanie dla danego chorego terapii personalizowanej, zidentyfikowanie przyczyn oporności na daną terapię oraz ewentualne włączenie pacjenta do badań klinicznych nad nowymi lekami.
Dodatkowo PCBB prowadzi również badania naukowe. Jeśli pacjent wyrazi zgodę, to część jego tkanki może zostać przeznaczona do badań nad opracowaniem nowych metod leczenia nowotworów z których w przyszłości skorzystać będą mogli inni chorzy.
Więcej informacji na ten temat można znaleźć na stronie: pcbb.pl.
https://www.youtube.com/watch?v=OKOW2gOa7dw
MNM Diagnostics – analiza całego genomu w Polsce
Naukowcy z całego świata pracują nad stworzeniem innowacyjnych terapii przeciwko nowotworom. Prowadzone są liczne badania kliniczne z udziałem pacjentów onkologicznych, a na rynku farmaceutycznym pojawiają się nowe leki, dostępne dla coraz większej grupy pacjentów.
Szacuje się, że badanie jakim jest analiza całego genomu może prowadzić do zmiany podejścia terapeutycznego proponowanego przez lekarza nawet w 50% przypadków, w zależności od typu nowotworu i warunków klinicznych. Pacjenci poddani terapii personalizowanej dłużej utrzymują stabilny stan swojej choroby i dłużej żyją [2,6].
Zaawansowana diagnostyka genomowa staje się już standardem medycznym między innymi w Norwegii [9] i Stanach Zjednoczonych [10]. W Polsce technologię analizy całego genomu u pacjentów onkologicznych rozwija m.in. firma MNM Diagnostics, która za swoje działania została nagrodzona w kraju, jak i na arenie międzynarodowej.
Jednym z głównych założeń firmy jest wykorzystanie najnowocześniejszych technik sekwencjonowania DNA, uczenia maszynowego oraz sztucznej inteligencji do diagnostyki raka jajnika i piersi, a docelowo również innych typów nowotworów. Algorytm ma pozwolić na trafniejszy dobór terapii personalizowanych.
Sekwencjonowanie genomowe oraz analiza całego genomu niosą ogromny potencjał diagnostyczny również w innych chorobach powiązanych z profilem genetycznym pacjenta, dlatego MNM Diagnostics rozwija swoją technologię również w kierunku chorób rzadkich. Dzięki profilowaniu genomowemu pacjenci z rzadkimi genetycznie chorobami mają możliwość uzyskania bardzo precyzyjnej diagnozy.
MNM Diagnostics dołączyła niedawno do międzynarodowej inicjatywy badawczej powołanej do walki z COVID-19, w ramach której poszukuje wariantów genowych warunkujących podatność na ciężki przebieg infekcji wywołanej wirusem SARS-CoV-2. Uzyskane wyniki pozwolą m.in. na ocenę ryzyka powikłań COVID-19 u poszczególnych osób.
MNM Diagnostics zostało utworzone w 2018 roku i współpracuje z wieloma jednostkami medycznymi na świecie. Firma ma polskie korzenie, a wśród jej założycieli są absolwenci Uniwersytetu Oksfordzkiego, Uniwersytetu w Cambridge oraz Uniwersytetu w Bergen (Norwegia).
Więcej informacji można znaleźć na stronie mnm.bio.
Rozwój medycyny i zaawansowanych technologii diagnostycznych postępuje szybciej niż kiedykolwiek wcześniej, a zrozumienie informacji zawartych w naszych genomach odgrywa coraz większą rolę. Analiza całego genomu jeszcze do niedawna wydawała się być diagnostyką przyszłości.
Okazuje się jednak, że ta przyszłość… wcale nie jest tak odległa.
Literatura
- The rise of the genome and personalised medicine
- The Impact of Whole Genome Data on Therapeutic Decision-Making in Metastatic Prostate Cancer: A Retrospective Analysis
- https://www.ncbi.nlm.nih.gov/pmc/articles/PMC6850492/pdf/APM-127-303.pdf
- American Cancer Society Cancer Treatment & Survivorship Facts & Figures 2016-2017
- Breastcancer
- https://pubmed.ncbi.nlm.nih.gov/31570899/?from_term=genomic+profiling+cancer+patient&from_pos=2
- New Developments in Molecular Targeted Therapy of Ovarian Cancer – Luyao Guan
- https://www.ncbi.nlm.nih.gov/pmc/articles/PMC5302930/
- Genomics Core Facility (GCF)
- Center for Precision Disease Modeling: Genomics & Bioinformatics Unit
Materiał powstał we współpracy z firmą MNM Diagnostics




















Jaki jest aktualnie koszt takiego badania? Chodzi mi o badanie całego genomu u pacjenta onkologicznego. Co dalej z taką informacją? Poszukiwanie badań klinicznych?
Dziękujemy za zapytanie, w sprawie szczegółowego cennika najlepiej napisać do nas pod adres contact@mnm.bio. Raport diagnostyczny jest tworzony z myślą o klinicznym zastosowaniu zawartych w nim wyników, ma być podpowiedzią dla lekarza prowadzącego, wskazówką jak najlepiej pomóc Pacjentowi.
Raport diagnostyczny – czy ma zastosowanie diagnostyczne, kto podpisuje się pod takim raportem? Jaka jest wartość kliniczna badania WGS? Jakie wytyczne stosowane są w badaniu?