Artykuł na temat biobankowania tkanek nowotworowych autorstwa dr Marzeny Wojtaszewskiej – specjalistki biologii molekularnej pochodzi z marcowego wydania czasopisma popularno-naukowego GENETYKA – FAKTY I MITY. Więcej publikacji poświęconych tematyce onkologicznej oraz onkogenetyce znajdziecie Państwo na stronie www.genetyka.bio.
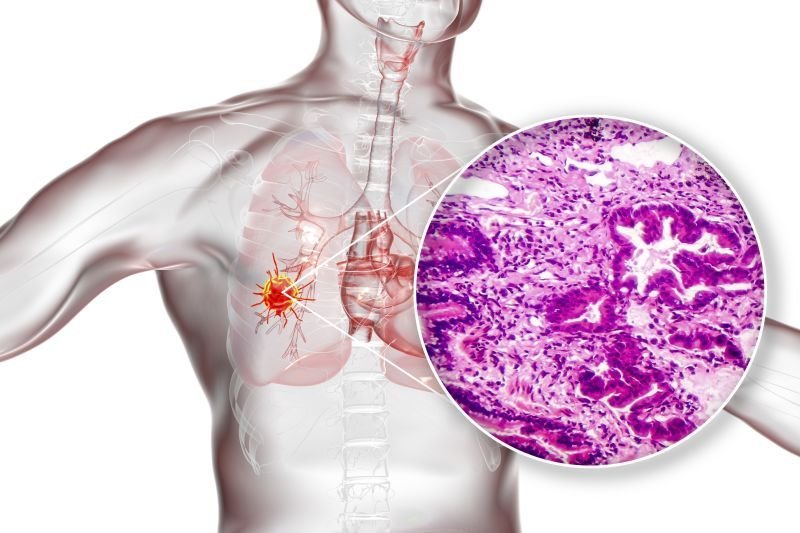
Biobankowanie tkanek nowotworowych
Na całym świecie standardowym postępowaniem w patomorfologii jest konserwowanie tkanek guza w celu wykonania badań histopatologicznych i genetycznych, w formie tzw. „bloczków parafinowych”, czyli preparatów utrwalonych buforowanym roztworem formaldehydu, a następnie zatopionych w parafinie w plastikowej kasetce.
Mimo niewątpliwych zalet tego rozwiązania dla uzyskania najlepszej jakości preparatów mikroskopowych, konserwowanie tkanek stało się hamulcem dla rozwoju genomiki nowotworów.
Wykonanie dobrej jakości preparatów histopatologicznych jest bezwzględnym warunkiem dla dobrej diagnostyki nowotworów. Inkubacja preparatów ok. 48 godzin w roztworze buforowanej 10% formaliny (tzw. NBF, neutral-buffered formallin) zapobiega niekontrolowanemu odwodnieniu i zniszczeniu ultrakstruktury komórek, nie pozwala na rozkład tkanki przez mikroorganizmy i zapewnia odpowiednią porowatość, by do materiału mogły penetrować odczynniki barwiące.
Z drugiej strony, formalina prowadzi do usieciowania białek i zniszczenia niektórych epitopów, co zmniejsza skuteczność barwienia immunohistochemicznego niektórymi przeciwciałami. Formalina pogarsza także jakość kwasów nukleinowych, co nie stanowi dużego problemu w przypadku badań małych wariantów w panelach NGS, jest jednak znaczącą przeszkodą dla analiz całogenomowych, uwzględniających np. sygnatury genetyczne czy analizę rearanżacji i zmian liczby kopii.
A takie badania są powoli uznawane za nowy złoty standard diagnostyczny w krajach rozwiniętych – m.in. dzięki brytyjskiemu projektowi „100000 Genomes” czy też badaniom dużych ośrodków w Stanach Zjednoczonych i Skandynawii.
Zaletami sekwencjonowania całogenomowego tkanki guza w stosunku do panelowego NGS są między innymi zdolność do wywoływania zmian liczby kopii, rearanżacji strukturalnych takich jak fuzje genowe czy inwersje oraz możliwość analizy liczby globalnych zjawisk genomowych, takich jak sygnatury genetyczne pojedynczego nukleotydu, całkowita liczba mutacji (TNB) czy niestabilność mikrosatelitarna.
Warunkiem koniecznym dla powodzenia takich analiz jest posiadanie dużej ilości (>5ug) dobrego jakościowo DNA. Wyklucza to w zasadzie zastosowanie tkanek konserwowanych formaliną (tzw. FFPE, paraffin embedded, formalin fixed). Niestety, roztwór formaliny powoduje pofragmentowanie DNA, wprowadza losowe zmiany pojedynczego nukleotydu i prowadzi do szybszego „starzenia się” próbki, czyli przyspieszonego utleniania łańcucha i wprowadzania kolejnych artefaktów [1,2].
Odbija się to na jakości sekwencjonowania: spada mapowalność odczytów (tracone jest nawet 10% readów), podwyższa się poziom tła, zmniejsza się rozdzielczość, z jaką wykrywane są warianty strukturalne, czasami pojawiają się także pojedyncze fałszywie dodatnie warianty. Co więcej, wykorzystanie najbardziej rzetelnej metody tworzenia bibliotek (bez amplifikacji PCR) nie jest możliwe z uwagi na zbyt mała ilość materiału, jaka otrzymywana jest z tkanki utrwalonej [1–3].
Problemy te nie są aż tak odczuwalne w przypadku sekwencjonowania panelowego i wywoływania jedynie małych wariantów SNV i InDel, jednak i tu genetycy spotykają się czasami z problemem nadmiernej degradacji materiału, wynikającej m.in. z użycia błędnie przygotowanego roztworu NBF lub wykorzystania zbyt starej, przechowywanej w nieodpowiednich warunkach, tkanki.
Wykorzystanie tkanki utrwalonej podwyższa także koszty NGS: wymusza konieczność odparafinowania tkanki i korzystania z dodatkowych tagów (np. UMI) do bibliotek NGS, zmniejszających ryzyko wyniku fałszywie dodatniego [2–4].
Formaldehyd używany w NBF posiada jeszcze jedną, mówiąc delikatnie, niedogodność: jest karcynogenny. To tajemnica poliszynela, że długoletnia ekspozycja na opary roztworu konserwującego znacząco zwiększa ryzyko wystąpienia raka nosogardzieli i chorób rozrostowych układu krwiotwórczego.
Niestety, narażony jest na nie głównie personel najniższego szczebla, technicy patomorfologii i laboranci, a nie lekarze patomorfolodzy, stąd też brak nacisków środowiska patomorfologicznego na zastąpienie NBF innym medium. Aktywiści zwracający uwagę na ten problem mówią wręcz o „dogmacie formalinowym”, który doprowadził do sytuacji, że ewidentnie rakotwórcza substancja jest w handlu oznaczana jedynie jako drażniąca (!) [5].
Jeśli podejdziemy racjonalnie do sprawy biobankowania materiału i patomorfologii, świat znacząco zmienił się od zeszłego wieku, kiedy to zarówno HE jak i formalina były najlepszym, co patomorfologia mogła zaproponować.
Obecnie istnieją publikacje dotyczące innych rozwiązań, takich jak BE70, w którym to zbuforowany etanol 70% jest jedynym utrwalaczem [6]. Istnieje też cały szereg komercyjnych mediów, a każde z nich jest co najmniej tak dobre jak roztwór formaldehydu, a wielokrotnie mniej szkodliwe dla kadry medycznej. Co więcej, media te powodują mniejszą degradację kwasów nukleinowych i zachowują lepiej strukturę białek, co pokazano m.in. w szeregu eksperymentów western blot [5].
Są oczywiście wady, które częściowo tłumaczą niechęć patomorfologów do nowych eksperymentów: chodzi o niuanse dotyczące zmian w kontrastach barw czy lekkich różnic w cechach morfologicznych komórek, których trzeba by się na nowo nauczyć przy zmianie metody utrwalania.
Innym rozwiązaniem problemu „dogmatu formalinowego”, przynajmniej w odniesieniu do pozyskiwania tkanki do badań genomowych, jest sposób… najprostszy, a jednocześnie najtrudniejszy: czyli wprowadzenie do standardu postępowania zakładów patomorfologii (w przypadkach, gdy materiału jest dostatecznie dużo) dodatkowego biobankowania świeżej tkanki równolegle do wykonywania preparatów utrwalonych.
Ideałem zaś byłoby, gdyby materiał nieutrwalony pozyskany z guza był lustrzanym odbiciem fragmentu tkanki pozyskanego do kasetki. Umożliwia to ocenę odsetka komórek nowotworowych w materiale wykorzystanym do NGS, choć komplikuje oczywiście postępowanie technika. Niemniej jednak taką strategię zastosowano w Wielkiej Brytanii, gdzie narodowemu konsorcjum Genomic England udało się skoordynować krajową sieć laboratoriów patomorfologicznych, by na poczet projektu 100K Genomes oraz przyszłej rutynowej diagnostyki genomowej pozyskiwały w sposób wystandaryzowany tkankę nieutrwaloną – zarówno z biopsji cienko i gruboiglowych, popłuczyn, jak i z całych organów poddanych resekcji.
Brytyjczycy, gdy to tylko możliwe, lustrzane próbki guza mrożą (zanurzając w ciekłym azocie lub psikając tzw. „cryosprayem”, czyli podręcznym zbiornikiem z ciekłym azotem lub zestalonym dwutlenkiem węgla). Cała procedura z licznymi jej odmianami dla biopsji cienko i gruboigłowych, preparatów dużych i małych, śródoperacyjnych i ambulatoryjnych została profesjonalnie sfilmowana.
Poniżej przedstawiamy jeden z filmików, przedstawiający postępowanie z tkanką raka jasnokomórkowego nerki.
Żeby nie było tak różowo, mrożenie w ciekłym azocie rzeczywiście zapobiega degradacji DNA i poprawia wyniki niektórych badań białkowych, jednak nie zapobiega całkowicie degradacji RNA, szczególnie przy dłuższym przechowywaniu tkanki. Co prawda RNA jest rzadziej wykorzystywane w genetyce onkologicznej, jednak odzwierciedla ono lepiej faktyczny stan produkcji białek w komórce, bez niego trudno jest stwierdzić na przykład, czy uszkodzone przez mutację białko jest w ogóle produkowane.
Także dzięki analizom transkryptomu wiemy, czy potencjalny nowy gen fuzyjny, który jest obiecującym celem terapii personalizowanej, ulega w ogóle transkrypcji. By zachować RNA możliwe jest zabezpieczanie tkanek w innym niż alkohol medium, na przykład za pomocą protokołu PAXgene 7.
Wydaje się, że zabezpieczenie tkanki do analiz patomorfologicznych nie zostanie w żaden sposób zakłócone, nawet jeśli zastosujemy szereg eksperymentalnych sposobów biobankowania tkanek, a bycie otwartym na nowe rozwiązania pozwoli udoskonalić diagnostykę onkologiczną z korzyścią dla pacjenta.
Biobanki onkologiczne
Okazuje się jednak, że ludzka natura i przyzwyczajenia nie są największą przeszkodą do biobankowania tkanek onkologicznych do badań genomowych i transkryptomowych. To co zrobili Brytyjczycy było ekstremalnie trudnym zadaniem i nie chodzi wcale o koszt przechowywania materiału ani o problem degradacji kwasów nukleinowych – biobanki onkologiczne świeżej tkanki próbuje się wdrażać w wielu krajach świata, jednak często napotykają one na problemy legislacyjne, proceduralne, a także logistyczne, których bez wsparcia krajowego prawodawstwa i rozwiązań systemowych nie da się rozwiązać na dużą skalę.
Biobanki (zarówno publiczne jak i prywatne) jako instytucje są skarlałe, rozrzucone po świecie, niechętne do dzielenia się zasobami i prowadzące dokumentację medyczną właścicieli swoich próbek w sposób chaotyczny i niezharmonizowany [8].
W niektórych krajach, takich jak Stany Zjednoczone, powstają prywatne biobanki onkologiczne, które z mozołem próbują radzić sobie z przeszkodami biurokratycznymi i oddolnie poruszają zardzewiałą machiną urzędniczą, by doprowadzić do zmiany status quo w patomorfologii.
Przykładem obiecującego banku tego typu jest https://storemytumor.com/, oferujący pacjentom biobankowanie na zasadach podobnych do bankowania krwi pępowinowej.
Wydaje się jednak, że nie jest to właściwa droga, a jedynym sposobem na zapewnienie biobankom tkanek nowotworowych należnego im miejsca w diagnostyce i naukach biomedycznych jest zapewnienie im odpowiednich warunków narodowych i międzynarodowych do rozwoju oraz wspieranie projektów dzielenia się zasobami i finansowanie rozwoju infrastruktury niezbędnej do długotrwałego przechowywania próbek biologicznych i danych – zarówno tych genomowych, jak i klinicznych.
Bibliografia
1. Piskorz AM, Ennis D, Macintyre G, et al. Methanol-based fixation is superior to buffered formalin for next-generation sequencing of DNA from clinical cancer samples. Ann Oncol. 2016;27(3):532-539. doi:10.1093/annonc/mdv613
2. Robbe P, Popitsch N, Knight SJL, et al. Clinical whole-genome sequencing from routine formalin-fixed, paraffin-embedded specimens: pilot study for the 100,000 Genomes Project. Genet Med. 2018;20(10):1196-1205. doi:10.1038/gim.2017.241
3. Eijkelenboom A, Kamping EJ, Kastner-van Raaij AW, et al. Reliable Next-Generation Sequencing of Formalin-Fixed, Paraffin-Embedded Tissue Using Single Molecule Tags. J Mol Diagn. 2016;18(6):851-863. doi:10.1016/j.jmoldx.2016.06.010
4. Kofanova O, Bellora C, Garcia Frasquilho S, et al. Standardization of the preanalytical phase of DNA extraction from fixed tissue for next-generation sequencing analyses. New Biotechnol. 2020;54:52-61. doi:10.1016/j.nbt.2019.07.005
5. Kothmaier H, Rohrer D, Stacher E, Quehenberger F, Becker K-F, Popper HH. Comparison of formalin-free tissue fixatives: a proteomic study testing their application for routine pathology and research. Arch Pathol Lab Med. 2011;135(6):744-752. doi:10.1043/2009-0676-OA.1
6. Perry C, Chung J-Y, Ylaya K, et al. A Buffered Alcohol-Based Fixative for Histomorphologic and Molecular Applications. J Histochem Cytochem Off J Histochem Soc. 2016;64(7):425-440. doi:10.1369/0022155416649579
7. Groelz D, Sobin L, Branton P, Compton C, Wyrich R, Rainen L. Non-formalin fixative versus formalin-fixed tissue: A comparison of histology and RNA quality. Exp Mol Pathol. 2013;94(1):188-194. doi:10.1016/j.yexmp.2012.07.002
8. Silberman S. Libraries of Flesh: The Sorry State of Human Tissue Storage. Wired. 2010;18(6). https://www.wired.com/2010/05/ff_biobanks/. Accessed January 16, 2020.
POLECAMY: ONKOPEDIA