Rola mikroflory jelitowej / mikrobiomu w chorobie nowotworowej
Szacuje się, że około 30-40% wszystkich zachorowań na nowotwory ma związek z żywnością, nieprawidłowym sposobem odżywiania oraz czynnikami związanymi z trybem życia. Przytłaczająca ilość danych klinicznych wskazuje, że czynniki żywieniowe (w szczególności te, które prowadzą do nadwagi oraz otyłości) istotnie wpływają na ryzyko rozwoju i umieralności z powodu raka. Dotyczy to w dużym stopniu m.in raka jelita grubego.
Stan zapalny został uznany za czynnik predysponujący do rozwoju raka już w 1863 roku. Obecnie potwierdzono, że przynajmniej 20% wszystkich przypadków zachorowań na raka jest bezpośrednią konsekwencją przewlekłego stanu zapalnego w organizmie.
Chroniczne stany zapalne jelit, jak choroba Crohna, czy wrzodziejące zapalenie jelita grubego, są uznane za czynniki ryzyka dla rozwoju raka jelita grubego. Rozwój tych chorób wiąże się bezpośrednio z reakcjami geny-środowisko. Rak jelita grubego najczęściej występuje spontanicznie w krajach o wysokim standardzie życia. Tylko 25% przypadków jest związanych z przypadkami występującymi w rodzinie.
Z drugiej strony, infekcje o podłożu bakteryjnym oraz wirusowym są uznanym czynnikiem wspierającym proces kancerogenezy w niektórych narządach. Jednym z najbardziej powszechnych przypadków jest wirusowe zapalenie wątroby, które może powodować raka wątrobowokomórkowego, czy infekcja bakterią Helicobacter pylori prowadząca do rozwoju gruczolakoraka żołądka.
Jak działa bariera jelitowa
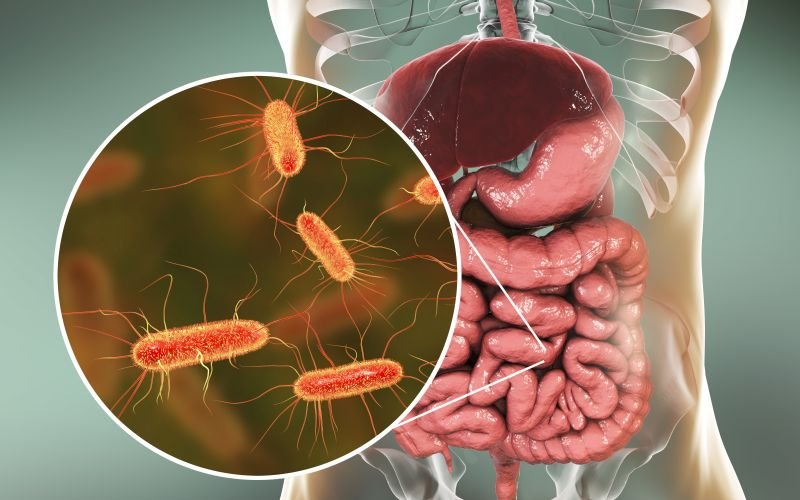
Bariera jelitowa oddziela w środowisko zewnętrzne od środowiska wewnętrznego organizmu. Ma kilka warstw, a składa się z komórek nabłonka jelitowego połączonego ścisłymi złączami (ang. tight junctions, TI), mikrobiomu (mikroflory jelitowej), śluzu, komórek układu immunologicznego oraz komórek układu nerwowego, krwionośnego i chłonnego.
W skład mikroflory jelitowej wchodzą głównie bakterie beztlenowe, w mniejszym stopniu bakterie tlenowe, ale również drożdże i wirusy. Tworzą swoisty układ, który podlega zmianom w zależności od warunków panujących w jelicie.
Komórki nabłonkowe jelit tworzą fizyczną barierę i odpowiadają za wchłanianie substancji odżywczych z treści pokarmowej, ale również odgrywają rolę w modulowaniu odpowiedzi immunologicznej, m.in. biorą udział w uwalnianiu cytokin. Ścisłe złącza są natomiast odpowiedzialne za regulowanie przepuszczalności jelitowej.
Bariera jelitowa działa w taki sposób, że małe cząsteczki rozpuszczalne w wodzie (np. glukoza) mogą przez nią przenikać – w przeciwieństwie do większych cząsteczek.
ZOBACZ: RAK JELITA GRUBEGO – PRZYCZYNY
Mikrobiom i jego funkcje
Prawidłowy i niezaburzony mikrobiom wspiera procesy trawienne (przetwarzając składniki odżywcze w formy łatwe do strawienia) oraz immunologiczne. Dodatkowo, produkuje związki odżywiające komórki nabłonkowe jelit (np. maślan), pomaga regulować ich przepuszczalność oraz nasila produkcję śluzu. Mikrobiom pomaga chronić organizm gospodarza przed patogenami.
Rozregulowaną mikroflorę jelitową określa się mianem dysbiozy.
Mikrobiom a rozwój raka
W większości przypadków rak jelita grubego rozwija się z nabłonkowych komórek śluzówki jelita. Histologicznie najczęściej klasyfikowany jest jako gruczolakorak. Przyczyną źródłową pojawienia się raka jelita grubego (ale również innych typów nowotworów) jest utrata mechanizmów kontrolnych nad rozwojem oraz różnicowaniem zbuntowanej komórki.
Z uwagi na fakt, że pojedyncze mutacje nie są wystarczające do uwolnienia transformacji w nowotwór złośliwy w nabłonku jelitowym, musi dojść do akumulacji wielu mutacji protoonkogenów, genów supresorowych oraz genów naprawczych (naprawiających DNA).
Mikrośrodowisko odgrywa w tym procesie bardzo ważną rolę, a zwłaszcza sposób odżywiania oraz stan mikroflory jelitowej. Mikroflora jelitowa traci funkcje, jeśli warunki panujące w jelicie są niesprzyjające, np. poprzez niedostarczanie odpowiednich substancji odżywczych wspierających odpowiedni skład jakościowy mikrobiomu.
Przeprowadzono badania, w których dowiedziono, że zróżnicowanie nawyków żywieniowych jest odpowiedzialne za różną częstotliwość występowania raka jelita grubego pomiędzy podobnymi populacjami.
Nowotwory jelita ekstremalnie rzadko występują u rdzennych Afrykanów (mniej niż 1 przypadek na 100 000), jednocześnie występują dość często u Afroamerykanów (65 przypadków na 100 000 ludzi).
Wykazano, że większa konsumpcja produktów odzwierzęcych, wzrost poziomu toksycznego wodoru oraz bakterii produkujących wtórną żółć są odpowiedzialne za większą częstotliwość występowania przypadków raka jelita grubego u Afroamerykanów. Badania te wspierają hipotezę, że istnieje silna korelacja pomiędzy stosowaną dietą, a stanem mikroflory jelitowej.
ZOBACZ: PROFILAKTYKA RAKA
Mikroflora jelitowa a rak jelita grubego
Dysbioza mikrobiomu może prowadzić do rozwoju nowotworu również poprzez zaburzenie proporcji lub obecności bytujących szczepów. Saprofityczne, normalnie występujące bakterie mogą mieć szkodliwy efekt w przypadku dysbiozy, ponieważ mogą wykorzystać powstałą niszę i zacząć nadmiernie się rozmnażać.
Również bakterie egzogenne mogą wykorzystać niszę, jeśli mikroflora jest uboga. Infekcja jelita grubego skutkuje pośrednio i bezpośrednio transformacją neoplastyczną poprzez rozwinięcie przewlekłego stanu zapalnego. Stoją za nią mikroorganizmy, które w takich warunkach mają możliwość aktywowania specyficznych, kancerogennych szlaków sygnałowych (zależnie od szczepu oraz warunków).
Na przykład Enterococcus faecalis jest znany z produkowania nadtlenków, które mogą powodować uszkodzenia DNA. Dowiedziono, że E. faecalis może aktywować szlaki nie tylko prowadzące do rozległych uszkodzeń DNA, ale również może powodować zatrzymanie cyklu komórkowego oraz promować niewłaściwą segregację chromosomów w komórkach nabłonka jelita grubego.
Badania in vivo potwierdziły ten potencjalnie kancerogenny efekt, demonstrując go na gnotobiotycznych myszach (wolnych od wszelkich wykrywalnych mikroorganizmów i pasożytów), które zainfekowano E. faecalis. W efekcie rozwinęła się dysplazja związana z wrzodziejącym zapaleniem jelita grubego oraz gruczolakorak.
Kolejnym przykładem może być E. Coli, która może produkować genotoksynę – kolibaktynę. Eksperymenty polegające na infekowaniu zwierząt tymi szczepami skutkowały pęknięciami podwójnej helisy DNA w komórkach nabłonka jelit, prowadząc do zakłóceń mitotycznych oraz aberracji chromosomowych z towarzyszącą zwiększoną częstotliwością występowania mutacji genowych.
Dowiedziono również częstsze występowanie E. Coli zdolnej do produkowania kolibaktyny w biopsjach pacjentów chorych z powodu raka jelita grubego, w porównaniu do pacjentów z uchyłkowatością jelita grubego.
Bacteroides fragilis została również powiązana z występowaniem raka jelita grubego, gdyż jest zdolna do wydzielania toksyny – metaloproteinazy BTF. Kiedy komórki nabłonka jelit są eksponowane na działanie enterotoksyny, dochodzi do przecięcia molekuł odpowiadających za umocowanie komórek na podłożu (dochodzi do miejscowego uszkodzenia bariery jelitowej). W efekcie prowadzi to o aktywowania reakcji na stres oraz szlaku sygnałowego cytokin, co w efekcie implikuje wzmożone podziały komórkowe oraz aktywowanie onkogenów.
Bakterie mogą również promować chroniczny stan zapalny. Mikrośrodowisko zapalne prowadzi do podwyższonego poziomu reaktywnych form tlenu (RFT) oraz przedłużonej aktywności układu immunologicznego, co w konsekwencji powoduje uszkodzenie tkanek. W efekcie dochodzi do stymulacji onkogenów i obniżenia ekspresji genów supresorowych.
W stanie dysbiozy niektóre bakterie jelitowe prowadzą do podwyższonego poziomu RFT. W badaniach nad myszami z niedoborami enzymów chroniących przed podwyższonym poziomem stresu oksydacyjnego, np. peroksydazy glutationowej, dowiedziono, że są one bardziej wrażliwe na stany zapalne jelit i kancerogenezę. Przykładem może być infekcja H.pylori oraz B.fragilis.
Wykazano, że u myszy zainfekowanych Helicobacter hepaticus rozwija się nowotwór złośliwy spowodowany zapaleniem jelit. Dodatkowo, w badaniach transfer limfocytów T miał istotny wpływ na zahamowanie zapalenia jelita oraz kancerogenezy. Limfocyty T wykazują działanie antynowotworowe. Ich aktywność wpływa na odpowiedź ochronną przed nowotworem.
Nasze jelito to złożony układ w którym zachodzą złożone procesy oraz zależności. Proces kancerogenezy nie zachodzi w nim bezpośrednio, czy też w odpowiedzi na jeden konkretny czynnik.
Przewlekłe stany zapalne mogą odgrywać pośrednią rolę poprzez stymulowanie flory bakteryjnej w taki sposób, że promują rozwój bakterii o zdolnościach genotoksycznych.
Zauważono, że Pacjenci z rakiem jelita grubego przejawiają niestabilność w odniesieniu do składu mikroflory jelitowej i występujących w niej szczepów w stosunku do zdrowych osób. Okazuje się, że Fusobacterium nucleatum jest obecny w podwyższonej ilości w tkance nowotworowej. Podwyższone stężenie bakterii idzie w parze z niestabilnością telomerów (część chromosomów).
Dodatkowo, stwierdzono, że obecność tej bakterii w tkance raka jelita grubego była odwrotnie proporcjonalna do nagromadzenia limfocytów T. F. nucleatum, B. fragilis oraz Fusobacterium prausnitzii są potencjalnymi biomarkerami raka jelita grubego.
Mikrobiom i mikroflora jelita a profilaktyka raka
Biorąc pod uwagę liczne badania nad mikroflorą jelitową oraz udowodniony wpływ dysbiozy na procesy onkogenne, można wykorzystać poznane mechanizmy w profilaktyce raka. Przede wszystkim ważne jest niedopuszczenie do rozwinięcia się stanu zapalnego jelit oraz utrzymywanie homeostazy mikrobiomu (w celu utrzymania stosunkowo niskiej populacji potencjalnie onkogennych bakterii).
Mikroorganizmy bytujące w jelicie produkują na drodze fermentacji maślan, krótkołańcuchowy kwas tłuszczowy (SCFA, ang. short-chain fatty acid) z nieulegających trawieniu włókien. Związek ten inicjuje zahamowanie wzrostu oraz apoptozę komórek nabłonka jelit w badaniach in vitro.
SCFA pełnią nie tylko rolę hamującą onkogenezę, ale również przeciwzapalną. Dodatkowo, zostało udowodnione, iż prebiotyki takiej jak laktuloza oraz inulina powodowały obniżenie uszkodzeń DNA w jelitach gryzoni.
Modulowanie mikroflory jelitowej probiotykami i prebiotykami pozytywnie wpływa na jej oddziaływanie z układem odpornościowym. W efekcie może mieć to pozytywny wpływ w kontekście ograniczenia rozwoju nowotworów.
Modele przedkliniczne dostarczają dowodów, że suplementacja probiotykami ma działanie ochronne przed transformacją nowotworową poprzez ochronę przed uszkodzeniami DNA oraz nadmierną proliferacją komórek. Dodatkowo, prebiotyki redukują ogniska nieprawidłowych krypt jelitowych oraz formowanie SCFA, obniżają ekspresję cytokin prozapalnych, inhibicję działania patogenów i mikrobów onkogennych oraz redukują prokancerogenną aktywności enzymatycznej.
Mikrobiom jako terapia wspomagająca
Pacjenci poddawani chemioterapii lub radioterapii doświadczają wielu efektów ubocznych leczenia, takich jak wymioty, biegunki czy utrata apetytu. W konsekwencji prowadzi to często do rozwoju niedożywienia, utrata wagi czy podatności na infekcje.
Symptomy te mogą mieć bezpośrednią przyczynę w dysbiozie mikroflory jelitowej. W przypadku dysbiozy jelit, parametry takie jak poziom wody w organizmie, stężenie jonów, ciśnienie osmotyczne oraz pH są często zaburzone. W konsekwencji prowadzi do namnażania bakterii przyczyniających się do dalszego zaburzenia homeostazy oraz pośredniczących w utrzymaniu agresywnego stanu zapalnego.
Stan zapalny prowadzi do uszkodzenia nabłonka jelit poprzez redukowanie zróżnicowania bytujących mikroorganizmów oraz umożliwienie gatunkom patogennym do zdominowania mikrośrodowiska.
Badania nad poziomem występowania różnych gatunków bakterii bytujących w jelicie udowodniły, że suplementacja probiotykami może przywrócić do normalnego poziomu nawet 5-krotny przyrost Fusobacterium – bakterii, która jest potencjalnym patogenem oraz występuje licznie w mikroflorze pacjentów cierpiących z powodu raka jelita grubego.
Poprzez wprowadzanie brakujących szczepów bakteryjnych, probiotyki przejawiają działanie antagonistycznie do patogenów jelita.
Probiotyki i ich właściwości w leczeniu onkologicznym
Probiotyki działają przeciwko patogenom jelita. Powodują obniżanie poziomu cholesterolu we krwi, redukują stany zapalne (w tym dotyczy to również stan wrzodziejącego zapalenia jelita), regulują procesy metaboliczne gospodarza oraz modulują jego układ odpornościowy.
W ostatnich latach wpływ stosowania probiotyków oraz prebiotyków był intensywnie badany w kontekście kontroli początkowych stadiów progresji różnego rodzaju chorób lub jako terapia wspierająca (np. przy zakażeniu wirusem grypy, niealkoholowej stłuszczeniowej chorobie wątroby, chorobie Parkinsona, czy zapaleniu trzustki).
Stosowanie probiotyków i prebiotyków jest proponowane jako potencjalna terapia wspierająca leczenie przeciwnowotworowe. Udowodniono, że probiotyki oraz prebiotyki mogą podwyższyć bezpieczeństwo stosowania oraz minimalizować występowanie efektów ubocznych standardowych terapii przeciwnowotworowych.
Poza bezpośrednim przywracaniem homeostazy mikroflory jelitowej, probiotyki prezentują szereg funkcji przeciwnowotworowych. Przyczyniają się do stymulowania układu immunologicznego, usprawniają działanie bariery jelitowej poprzez wydzielanie molekuł przeciwnowotworowych oraz antyoksydacyjnych, a w końcu poprzez aktywację komórek mononuklearnych limfocytów i podwyższenie produkcję immunoglobuliny A.
Suplementacja probiotykami redukuje ekspresję specyficznych receptorów, co prowadzi do uszczelnienia bariery jelitowej oraz prowadzi do aktywowania fagocytów, które przyczyniają się do utrzymywania stanu czujności przeciwko komórkom nowotworowym, w szczególności we wczesnych fazach rozwoju.
W przypadku raka jelita grubego suplementacja probiotykami w celu modulowania mikrobiomu jelitowego oraz odpowiedzi immunologicznej okazała się potencjalnie obiecującym podejściem do hamowania progresji raka oraz podwyższenia efektywności chemioterapii.
Badania na zwierzętach dowodzą, że występujące naturalnie Bifidobacterium longum i Bifidobacterium breve spowodowały istotną redukcję rozwoju nowotworów oraz podwyższyły efektywność immunoterapii przeciwciałami anty-PD-L1.
Natomiast suplementacja Lactobacillus lactis spowodowała redukcję stężenia nadtlenku wodoru oraz aktywności peroksydazy, co prowadziło w konsekwencji do obniżenia stanu zapalnego tkanki jelitowej oraz jej uszkodzeń w badaniach na myszach. Zebrane dotychczas wyniki badań sugerują, że bakterie wchodzące w skład mikroflory jelitowej wpływają na poziom cytokin.
Suplementowanie probiotykami ma również wpływ na cofanie zespołu wyniszczenia nowotworowego (kacheksja). W badaniach na zwierzętach z białaczką oraz u których rozwinęła się kacheksja – suplementowanie probiotykami przywróciło odpowiedni poziom bakterii z grupy Lactobacillus, zredukowało poziom markerów zaniku mięśni oraz poziom prozapalnych cytokin.
Podobnie, suplementacja prebiotykami w badaniach nad zwierzętami prowadziła do unormowania mikroflory jelitowej, w tym przywrócenia poziomu korzystnie działających Bifidobacterium, a przez to do opóźnienia rozwinięcia się stanu kacheksji.
Niektóre badania wykazały, że probiotyki działają efektywnie jako terapia wspierająca do leczenia chemioterapią oraz radioterapią pacjentów z rakiem jelita grubego. Podawanie Lactobacillus rhamnosus obniżyło częstotliwość biegunek, czy rozstroju żołądka.
Przeprowadzono randomizowaną próbę kliniczną, w której badano efektywność oraz tolerancję LActobacillus rhamnosus u chorych z biegunką spowodowaną radioterapię. Badania te wykazały, że u pacjentów, którzy dostawali probiotyki, biegunki występowały rzadziej i w mniejszym stopniu.
Prebiotyki – rola i właściwości
Dieta jest ważnym czynnikiem ryzyka podatności na rozwój raka jelita grubego. Dlatego też uważa się, że prebiotyki odgrywają istotną rolę w utrzymaniu gospodarza w dobrym zdrowiu.
Prebiotykami są węglowodany, głównie oligosacharydy, włączając fruktooligosacharydy, ksylooligosacharydy, inulinę, fruktany oraz galaktogliosacharydy. Są to substancje nieulegające trawieniu w jelicie cienkim. Dzięki temu dostają się do jelita grubego, gdzie ulegają fermentacji przez bakterie mikroflory.
Suplementacja prebiotykami hamuje formowanie się nieprawidłowych krypt jelitowych, redukuje pH w jelicie ślepym oraz przejawia efekty przeciwnowotworowe poprzez obecność skrobi, inuliny oraz innych oligo-fruktanów.
Udowodniono, że prebiotyki odgrywają ważną przeciwnowotworową rolę poprzez hamowanie ekspresji specyficznych molekuł onkogennych poprzez stymulowanie rozwoju Bifidobacterium oraz aktywowanie układu immunologicznego. Prebiotyki mogą również modulować mikrobiom poprzez hamowanie namnażania patogenów oraz stymulowanie apoptozy.
Probiotyki oraz prebiotyki przejawiają działanie synergistyczne, tzn., że ich działanie dopełnia się i nawzajem wzmacnia.
Kilka niezależnych analiz wskazało istotność składu gatunkowego mikroflory jelitowej u pacjentów onkologicznych w trakcie chemioterapii lub immunoterapii blokującej punkty kontrolne cyklu komórkowego.
Dowiedziono, że poszczególne szczepy mikroflory jelitowej mają wpływ na sukces immunoterapii nowotworów, poprzez zwiększenie aktywacji komórek dendrytycznych oraz eksponowanie limfocytów T przeciwko komórkom nowotworowym.
Probiotyki u pacjentów onkologicznych – zalecana ostrożność
Niektóre z poznanych sposobów wpływania na poprawę stanu mikroflory bakteryjnej mogą być zbyt obciążające lub niewskazane dla pacjentów onkologicznych – w zależności od etapu ich leczenia oraz ogólnego stanu zdrowia. Zawsze warto indywidualnie konsultować się z dietetykiem w celu dobrania odpowiedniego sposobu odżywiania.
U pacjentów onkologicznych z obniżoną odpornością samodzielne przyjmowanie probiotyków złożonych z jednego lub kilku szczepów bakteryjnych może prowadzić do bakteriemii lub grzybicy układowej.
Stwierdzono przypadki zakażenia Lactobacillus oraz Bifidobacterium, natomiast w jednym przypadku suplementowanie samym Saccharomyces cerevisiae (przeciwko biegunce związanej z namnożeniem Clostridium difficile) spowodowało u pacjenta sepsę.
Mikroflora jelitowa – co jej szkodzi
Dysbioza mikrobiomu jest nowym negatywnym czynnikiem prognostycznym raka. Pełni rolę w regulowaniu przepuszczalności bariery jelitowej. Z kolei bariera ta może być regulowana przez czynniki patologiczne, jeśli doszło do zaburzeń czynników fizjologicznych.
Mikrobiom reguluje przepuszczalność bariery jelitowej głównie przez produkcję SCFA (krótkołańcuchowych kwasów tłuszczowych) oraz wydzielanie substancji czynnych.
Innymi czynnikami powodującymi deregulację mikrobiomu są alkohol, leki (zwłaszcza antybiotyki), przetworzona żywność oraz niedobory witamin i minerałów.
Zonulina jest substancją używaną do określenia stopnia przepuszczalności bariery jelitowej. Jest to związek, który prowadzi do rozluźniania ścisłych złącz pomiędzy komórkami nabłonka jelit. W ten sposób patogeny mogą łatwo penetrować do wnętrza organizmu. Poziom zonuliny jest podwyższany przez cytokiny prozapalne oraz znajdujący się w treści pokarmowej gluten.
Antybiotykoterapia, stres, toksyny, niedożywienie (np. jakościowe) wpływają negatywnie na stan mikrobiomu. Nieprawidłowa dieta ma szkodliwe działanie na mikroflorę jelitową. Dieta prozapalna wspierająca utrzymywanie się stresu oksydacyjnego (uboga w antyoksydanty) oraz obfita w gluten, tłuszcze zwierzęce oraz cukry proste – wpływa negatywnie na stan mikrobiomu o przyczyniają się do rozwoju komórek nowotworowych.
Czynniki wspierające homeostazę mikrobiomu
Mikroflora jelitowa w stanie homeostazy jest pozytywnym czynnikiem prognostycznym w przypadku raka jelita grubego. Przy obecnym stanie wiedzy oraz poziomie technologicznym możliwe jest modulowanie mikrobiomu poprzez odpowiedni sposób odżywiania, przyjmowanie probiotyków, prebiotyków (lub pokarmów bogatych probiotyki i prebiotyki).
Zalecane są przede wszystkim produkty fermentacji, czyli kiszonki, zsiadłe mleko, maślanka, itd.) oraz prozdrowotne posty.
Pozytywny wpływ na nasz mikrobiom ma stosowanie diety przeciwzapalnej. Chodzi przede wszystkim o dietę bogatą we włókna pokarmowe, antyoksydanty, roślinne sterole, cynk i selen – z jednoczesnym ograniczeniem cukrów prostych, białek odzwierzęcych oraz przetworzonego jedzenia.
Regularne uprawianie sportu oraz unikanie toksyn również mają pozytywny wpływ na homeostazę mikrobiomu.
Colostrum a nowotwory
Colostrum czyli siara to naturalny produkt gruczołów mlekowych ssaków. Jest wyjątkowo bogate w substancje biologicznie czynne białka, witaminy, sole mineralne oraz w liczne szczepy bakteryjne naturalnie zasiedlające jelito.
Colostrum składa się z ok. 250 substancji, z czego białka to ok. 60% suchej masy. Dodatkowo, może zawierać nawet ok. 300 szczepów różnych bakterii. Skład colostrum różni się tylko nieznacznie pomiędzy gatunkami ssaków. Poprzez złożony i bogaty skład colostrum działa wielowymiarowo.
Główną jego rolą jest immunizacja noworodka oraz dojrzewanie układu pokarmowego. Colostrum wpływa pozytywnie na układ immunologiczny, m.in. poprzez dostarczenie bakterii jelitowych, ale również regulatorów odporności.
W przypadku nowotworów – colostrum utrzymuje stan wysokiej odporności, a przez to wzmacnia siły własne organizmu do zapobiegania transformacji nowotworowej. Dodatkowo, stwierdzono, że zawiera wysokie stężenie VEGF (naczyniowy czynnik wzrostu komórek endotelialnych).
Naturalnie VEGF jest odpowiedzialny za stymulowanie powstawania nowych naczyń włosowatych w uszkodzonych tkankach. Okazuje się, że na nowotwory działa odwrotnie, tj. hamuje proces angiogenezy (tworzenia nowych naczyń), pośrednio przyczyniając się do “zagłodzenia” guza i zahamowania jego wzrostu, a potencjalnie nawet do jego śmierci.
Podsumowując, colostrum jest naturalną i bezpieczną odpowiedzią na potrzeby pacjentów cierpiących z powodu dysbiozy jelit, również towarzyszącej nowotworowi, ze względu na bogaty skład oraz różnorodność obecnych w nim szczepów bakterii.
Mikrobiom i mikroflora jelitowa w profilaktyce raka, źródła i bibliografia:
- Elizabeth Thursby and Nathalie Juge; Introduction to the human gut microbiota; Biochemical J 2017 Jun 1; 474(11): 1823–1836
- https://www.ncbi.nlm.nih.gov/pmc/articles/PMC5433529/#BCJ-2016-0510CC55
- https://www.ncbi.nlm.nih.gov/pmc/articles/PMC5433529/
- Maciej Hałasa, Dominika Maciejewska,1 Magdalena Baśkiewicz-Hałasa, Bogusław Machaliński, Krzysztof Safranow, and Ewa Stachowska; Oral Supplementation with Bovine Colostrum Decreases Intestinal Permeability and Stool Concentrations of Zonulin in Athletes; Nutrients. 2017 Apr; 9(4): 370
- https://www.ncbi.nlm.nih.gov/pmc/articles/PMC5409709/
- Olivia I. Coleman, Tiago Nunes; Diet, the Gut Microbiome, and Colorectal Cancer: Are They Linked?; Genetic Engineering and Biotechnology News, 2018
- https://www.genengnews.com/insights/diet-the-gut-microbiome-and-colorectal-cancer-are-they-linked/
- Lea B. S. Hansen, Henrik M. Roager, Oluf Pedersen; A low-gluten diet induces changes in the intestinal microbiome of healthy Danish adults; Nature Communications volume 9, Article number: 4630 (2018)
- https://www.nature.com/articles/s41467-018-07019-x
- Immunologiczne podstawy działania Colostrum; Dr n med. M. Hałasa
- https://docplayer.pl/16593591-Dr-n-med-maciej-halasa-immunologiczne-podstawy-dzialania-colostrum.html
- Carolina Vieira De Almeida, Marcela Rodrigues de Camargo, Edda Russo, Amedeo Amedei; Role of diet and gut microbiota on colorectal cancer immunomodulation; World J Gastroenterol. Jan 14, 2019; 25(2): 151-162
- https://www.wjgnet.com/1007-9327/full/v25/i2/151.htm
- Karolina Karabin; Zaburzenia przepuszczalności bariery jelitowej – możliwości diagnostyczne; Współczesna dietetyka, 2018
- http://www.wspolczesnadietetyka.pl/diagnostyka/zaburzenia-przepuszczalnosci-bariery-jelitowej-mozliwosci-diagnostyczne
- Dagmara Węgrzyn*, Karolina Adamek, Beata Łoniewska; Budowa bariery jelitowej; Pomeranian J Life Sci 2017;63(3):6-9
- Russo E, Amedei A. The Role of the Microbiota in the Genesis of Gastrointestinal Cancers. In: Frontiers in Anti-Cancer Drug Discovery, 7th ed; 2018
- Mego M, Chovanec J, Vochyanova-Andrezalova I, Konkolovsky P, Mikulova M, Reckova M, Miskovska V, Bystricky B, Beniak J, Medvecova L, Lagin A, Svetlovska D, Spanik S, Zajac V, Mardiak J, Drgona L. Prevention of irinotecan induced diarrhea by probiotics: A randomized double blind, placebo controlled pilot study. Complement Ther Med. 2015;23:356–362.
- Delia P, Sansotta G, Donato V, Frosina P, Messina G, De Renzis C, Famularo G. Use of probiotics for prevention of radiation-induced diarrhea. World J Gastroenterol. 2007;13:912–915.